– « Mécanismes et traitements des cholestases génétiques : PFIC2 et syndrome NISCH »
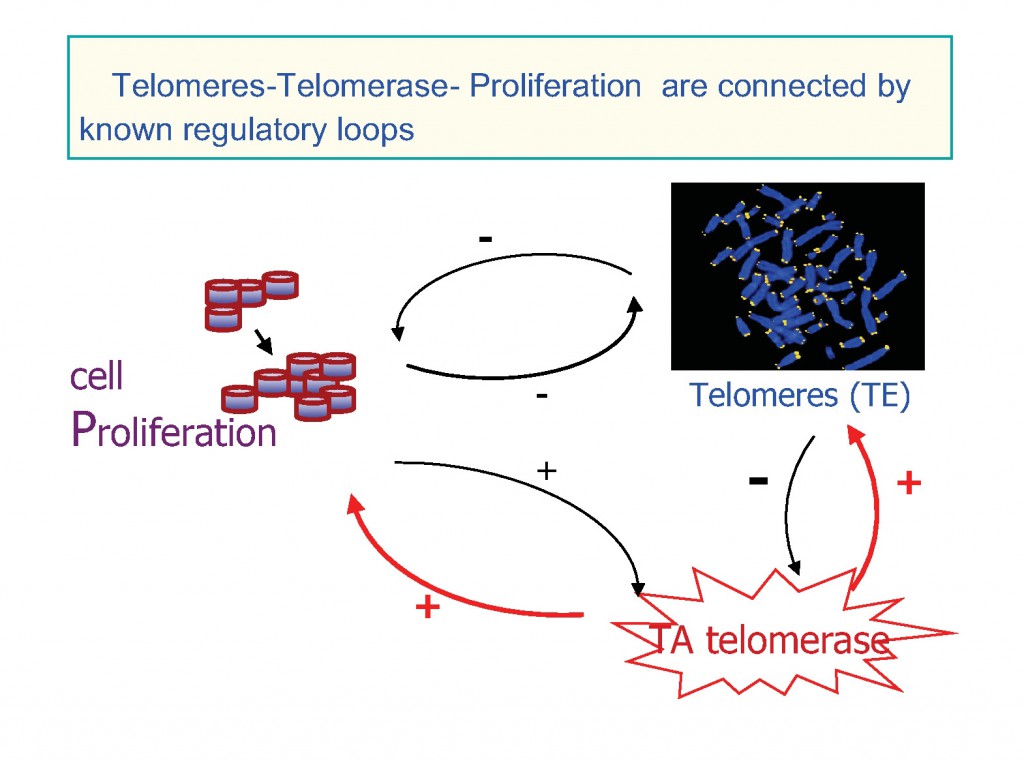
– « Rôle du récepteur sigma 1 au cours de la prolifération cellulaire »
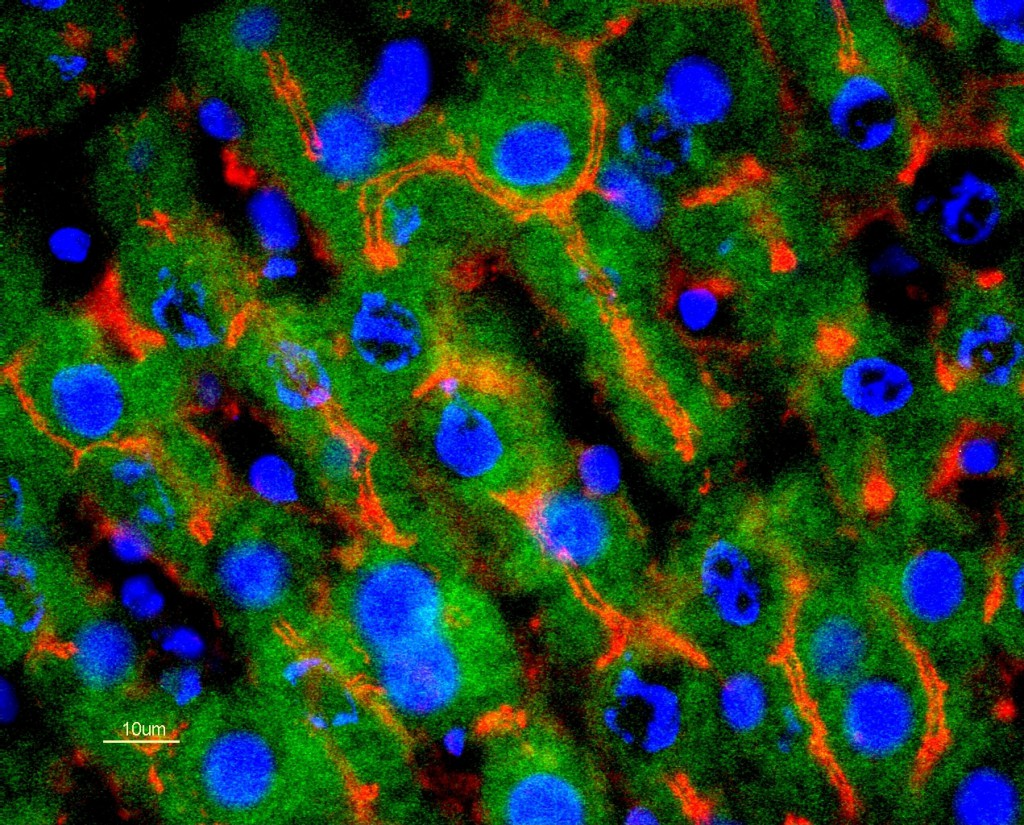
– « Interactions paracrines dans le foie : rôle de l’ATP »
– « Régulation de la régénération du foie par les signalisations calcique, purinergique et par les acides biliaires »
– « Dynamiques cellulaires et modélisation »
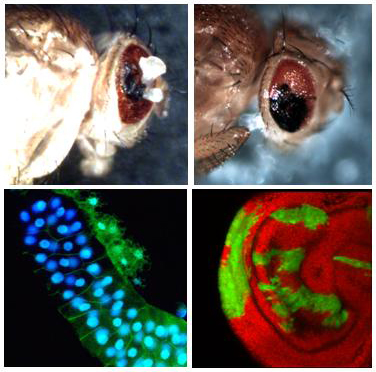
– « Régulation de l’expression génique »
« Mécanismes et traitements des cholestases génétiques : PFIC2 et syndrome NISCH »
Responsable : Pr E. Jacquemin, PU-PH service d’Hépatologie Pédiatrique (Pr O. Bernard) à l’hôpital de Bicêtre.
Ce service est aussi « Centre de référence des maladies rares du foie de l’enfant ». E. Jacquemin est rattaché à notre laboratoire depuis septembre 2008 où il dirige une équipe de biologistes cellulaires sur cette thématique.
Ce projet consiste notamment à caractériser dans des lignées hépatocellulaires polarisées que nous avons développées au laboratoire, les anomalies d’expression et de fonction de protéines mutées identifiées chez certains patients. Ce travail est réalisé en collaboration avec le service de Biochimie de l’Hôpital Bicêtre (Dr C. Baussan, Dr A. Spraul), qui est entre autre en charge du génotypage des patients.
Le but de cette recherche est de mieux comprendre les mécanismes impliqués dans ces maladies ce qui permettrait d’optimiser la prise en charge médicale des enfants atteints. Il s’agit donc d’un projet inter-UFR, pluridisciplinaire qui s’inscrit dans la politique de l’Université Paris Sud 11 qui veut développer un réseau d’interactions entre les différentes composantes de l’Université, notamment pour favoriser l’émergence d’une recherche translationnelle innovante à l’interface « Biologie fondamentale – recherche Clinique ».
« Rôle du récepteur sigma 1 au cours de la prolifération cellulaire »
Responsables : Laurent Combettes (DR Inserm)
Cette étude s’inscrit dans le cadre général du rôle de l’organisation spatio-temporelle des signaux calciques intracellulaires.
Le récepteur sigma 1 (s), protéine ubiquitaire de 223 acides aminés (25.3kD) qui n’a aucune homologie de séquence avec des protéines connues de mammifères, est particulièrement abondant dans le foie et le cerveau. Dans le système nerveux central où ces récepteurs ont été beaucoup étudiés, ils sont impliqués dans la régulation de la libération de neurotransmetteurs, les processus de l’apprentissage et de la mémoire et la régulation des mouvements et de la posture .
Les s sont aussi impliqués dans la prolifération cellulaire et une surexpression du récepteur s a été observée dans de nombreux cancers. Cette surexpression est telle dans certains cancers, (sein, prostate), que des ligands radioactifs des s ont été développés pour leur détection précoce par tomographie à émission de positons. Aucune étude en revanche n’a été réalisée sur les hépatocarcinomes.
Nous avons donc entrepris d’étudier l’expression de s dans des tumeurs hépatiques humaines. Par ailleurs, le mode d’action des s, reste largement inconnu cependant ils pourraient intervenir dans le contrôle de l’homéostasie calcique. Grâce à des modèles cellulaires « hépatiques », nous avons entrepris d’étudier si l’homéostasie du Ca2+ intracellulaire est affectée par la surexpression du s1.
« Interactions paracrines dans le foie : rôle de l’ATP »
Responsables : Laurent Combettes (DR Inserm), Thierry Tordjmann (DR Inserm)
Le laboratoire a entrepris d’étudier le mécanisme et le rôle de l’ATP extracellulaire dans la physio-pathologie hépatique. Des récepteurs purinergiques ont été mis en évidence sur la plupart des cellules du foie et l’ATP, notamment via l’augmentation du Ca2+ intracellulaire, induit de nombreuses réponses non seulement dans les hépatocytes, mais aussi dans les autres types cellulaires hépatiques. Cette signalisation purinergique semble jouer un rôle majeur dans la physiologie hépatique, non seulement en permettant l’adaptation des hépatocytes à leur changement de volume mais également en coordonnant les réponses cellulaires au sein du parenchyme hépatique. Pour autant les mécanismes de cette libération d’ATP extracellulaire et ses effets physiologiques et physiopathologiques sont peu connus.
Nos observations récentes montrent qu’il existe une brutale et intense libération d’ATP par le foie immédiatement après hépatectomie des deux tiers, dans le foie isolé perfusé et in vivo chez le rat anesthésié. Par ailleurs, l’ATP peut stimuler l’entrée des hépatocytes dans le cycle cellulaire après hépatectomie partielle chez le rat. Notre objectif est double : Comprendre les mécanismes de libération de l’ATP par les cellules hépatiques. En comprendre les conséquences fonctionnelles non seulement sur la prolifération des hépatocytes mais aussi sur les fonctions hépatiques, notamment la sécrétion biliaire.
En effet, l’ATP est également impliqué dans la régulation de la sécrétion biliaire. Les maladies cholestatiques de l’enfant représentent une part importante de l’activité clinique en hépatologie pédiatrique. Les enfants atteints peuvent parfois bénéficier d’un traitement par l’acide ursodésoxycholique, mais sont souvent en situation de difficulté thérapeutique et la greffe est encore à terme trop souvent la seule proposition thérapeutique. Dans ce contexte, la mise en évidence d’une libération d’ATP dans la bile par les hépatocytes susceptible de stimuler les cholangiocytes est une observation importante qui pourrait permettre de mieux comprendre la physiopathologie des cholestases de l’enfant, et de faire des propositions de nouvelles stratégies thérapeutiques. Des antagonistes spécifiques des récepteurs P2X commencent à être synthétisés. Nos études, en précisant les mécanismes de libération de l’ATP, le rôle des différents types de récepteurs purinergiques et les interactions entre les différents types cellulaires constitutifs du foie pourraient permettre d’envisager des stratégies pour moduler cette voie de signalisation à différents niveaux.
« Régulation de la régénération du foie par les signalisations calcique, purinergique et par les acides biliaires »
Responsable : Thierry Tordjmann (DR Inserm)
De nombreux agonistes génèrent dans les hépatocytes des oscillations et vagues calciques intra et intercellulaires. Nous avons démontré que la propagation de ces signaux dans le lobule hépatique était déterminée par un gradient de sensibilité aux agonistes, puis étudié leur impact physiologique dans le foie de rat. Nous avons montré que le flux biliaire était régulé par de tels signaux, et qu’il existait un profond remodelage de la signalisation calcique au cours de la régénération du foie. Nos travaux récents et en cours suggèrent que le calcium cytosolique régule la régénération du foie et que la vasopressine et de l’ATP extracellulaire (agonistes générant des signaux calciques hépatocytaires) sont impliqués au cours de la régénération chez les rongeurs mais aussi chez des patients après hépatectomie partielle (donneurs familiaux pour transplantation hépatique).
Notre objectif est de déterminer les mécanismes par lesquels la signalisation calcique, induite par des interactions paracrines ou endocrines, régule la régénération et la survie cellulaires dans le foie. Nos différents axes de recherche sont : 1. Interférer in vitro et in vivo avec le calcium cytosolique et nucléaire, puis analyser les conséquences de cette interférence sur la prolifération et la survie cellulaire. Nous transférons dans les cellules en culture ou le foie de souris (constructions adénovirales) des gènes codant pour des protéines liant le calcium ou l’inositol triphosphate (adressée dans le cytosol ou le noyau). Les voies de signalisation impliquées (dépendantes du calcium) sont analysées. 2. Etudier les mécanismes par lesquels l’ATP, messager paracrine mobilisant le calcium intracellulaire, régule la prolifération cellulaire pendant la régénération du foie après hépatectomie, en nous focalisant sur l’étude des récepteurs purinergiques P2X4 et P2X7 (très exprimés dans le foie). Cette étude bénéficie de souris KO pour ces récepteurs, dont nous disposons au laboratoire. 3. Etude de la régulation de la régénération du foie par les acides biliaires : rôle du récepteur TGR5. Immédiatement après hépatectomie des deux tiers, chez le rat mais aussi chez la souris et chez l’homme, nous avons observé une brutale et intense élévation de la concentration plasmatique en acides biliaires (« cholestase »). Les acides biliaires étant actuellement considérés comme des messagers endocrines, cette cholestase immédiate pourrait donc avoir un impact, via le récepteur de surface TGR5, sur la régulation précoce, endocrine et paracrine, de la régénération du foie. Nous disposons au laboratoire de souris KO pour ce récepteur (TGR5-KO).
« Dynamiques cellulaires et modélisation »
Une partie de notre laboratoire collabore avec des mathématiciens spécialistes des systèmes dynamiques en biologie. Cette multidisciplinarité nous permet d’associer dans nos recherches une approche fondamentale de « Mathématiques et modélisation des systèmes dynamiques en biologie ». Cette approche est permise grace entre autre à la collaboration que nous avons de longue date avec le laboratoire de Chronobiologie Théorique de la Faculté des Sciences de l’Université Libre de Bruxelles (Belgique) : http://www.ulb.ac.be/sciences/utc/
« Régulation de l’expression génique »
« Régulation de l’expression génique »
Responsable : Patricia Uguen (MCU)
Contrôle de l’expression des gènes par la 7SK snRNP.
Chez l’humain et la drosophile, 20 à 30% des gènes sont en état de pause transcriptionnelle. Cet état correspond à un arrêt réversible de l’élongation après la synthèse d’environs 25 à 50 nucléotides d’ARN. La majeure partie de ces gènes sont impliqués dans les programmes de développement, d’apoptose, de prolifération et de différenciation cellulaires… Cet état réversible permettrait un contrôle précis et rapide de la reprogrammation de l’expression du génome. Il faut noter que les mécanismes moléculaires contrôlant cette pause ne sont pas connus, mais on suppose à l‘heure actuelle qu’elle est régulée par le jeu conjugué de P-TEFb et de ces partenaires protéiques ou non. Le complexe P-TEFb existe sous deux formes, l’une qui active l’expression des gènes et l’autre qui l’inhibe. Dans sa forme inactive, il est entre autre associé à l’ARN 7SK et à la protéine HEXIM. L’objectif du projet est d’intégrer au niveau moléculaire et cellulaire le rôle régulateur de l’ARN 7SK et de ses partenaires protéiques (HEXIM, LARP7, P-TEFb, MePCE) sur la transcription des gènes. Une emphase particulière est portée sur les aspects liés à la régénération, cas particulier de prolifération et de différenciation cellulaires. Ceci est abordé par une approche multidisciplinaire alliant des méthodes biochimiques, génétiques, cellulaires et génomiques. La voie de signalisation de la 7SK snRNP pourra ainsi être replacée dans les réseaux de régulation des programmes transcriptionnels de la prolifération, de la régénération et de la différenciation cellulaire.